 Muchos recordaremos este invierno como uno de los más fríos de los últimos años. Fuertes vientos, lluvias constantes, mucha nieve, .... Y aunque en Canarias no es frecuente ver estampas nevadas como las que se ven en los bosques de Alemania, finalmente ha sido el último temporal el que nos ha dejado nieve en las cumbres.
Muchos recordaremos este invierno como uno de los más fríos de los últimos años. Fuertes vientos, lluvias constantes, mucha nieve, .... Y aunque en Canarias no es frecuente ver estampas nevadas como las que se ven en los bosques de Alemania, finalmente ha sido el último temporal el que nos ha dejado nieve en las cumbres.Pero si a gran escala la nieve nos proporciona paisajes de gran belleza, a nivel microscópico los cristales de hielo son una obra de arte.
 Sorprende saber que los copos de nieve se forman en las nubes sobre partículas de polvo, cuya superficie ayuda a que el vapor de agua se condense para convertirse luego en cristales de hielo. ¿Pero cómo adquieren esas formas simétricas tan espectaculares?
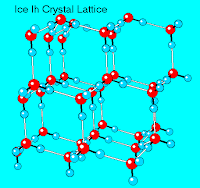
Sorprende saber que los copos de nieve se forman en las nubes sobre partículas de polvo, cuya superficie ayuda a que el vapor de agua se condense para convertirse luego en cristales de hielo. ¿Pero cómo adquieren esas formas simétricas tan espectaculares?Para entenderlo, necesitamos conocer en primer lugar cómo se ordenan las moléculas de agua en estado sólido, es decir la geometría de su estructura cristalina, la cual se encuentra fuertemente condicionada por la presencia de enlaces de hidrógeno entre las moléculas de agua. Son muchas las estructuras cristalinas que se conocen para el hielo, cada una de ella estable sobre un rango de presión y temperatura. En el hielo ordinario, que se forma a cero grados y 1 atm, cada molécula de agua forma cuatro enlaces de hidrógeno a otras cuatro moléculas de agua.

A nivel tridimensional, el hielo forma entonces una estructura de hexágonos arrugados o fruncidos. Cada lado del hexágono consiste de un enlace covalente O-H (ca. 0,98A) y de un enlace de hidrógeno (ca. 2,75A). Como resultado del arreglo hexagonal de las moléculas de H2O en la estructura cristalina, los cristales de nieve muestran una simetría hexagonal.
 A tamaños muy pequeños, los cristales de nieve toman la forma de prismas hexagonales, pero a medida que el cristal crece surgen pequeñas ramificaciones desde cada esquina del hexágono, ramificaciones que van creciendo en tamaño al continuar el proceso de cristalización y de las que a su vez brotan nuevas ramificaciones, obteniéndose formas más elaboradas además de únicas. El proceso por el que aparecen estas ramificaciones, así como la complejidad de las mismas, es tema de estudio en el área de física. La forma cómo crecen los cristales de nieve está sujeto a un delicado equilibrio entre hielo y vapor de agua, equilibrio que depende de la temperatura y la humedad del medio. Estos estudios son un buen ejemplo de lo que comúnmente se denomina ciencia básica. El conocimiento de cómo, cuándo y por qué se auto-ensamblan las moléculas de agua en determinadas estructuras, es potencialmente valioso pues podría permitir extrapolarlo a otro tipo de materiales y aplicaciones.
A tamaños muy pequeños, los cristales de nieve toman la forma de prismas hexagonales, pero a medida que el cristal crece surgen pequeñas ramificaciones desde cada esquina del hexágono, ramificaciones que van creciendo en tamaño al continuar el proceso de cristalización y de las que a su vez brotan nuevas ramificaciones, obteniéndose formas más elaboradas además de únicas. El proceso por el que aparecen estas ramificaciones, así como la complejidad de las mismas, es tema de estudio en el área de física. La forma cómo crecen los cristales de nieve está sujeto a un delicado equilibrio entre hielo y vapor de agua, equilibrio que depende de la temperatura y la humedad del medio. Estos estudios son un buen ejemplo de lo que comúnmente se denomina ciencia básica. El conocimiento de cómo, cuándo y por qué se auto-ensamblan las moléculas de agua en determinadas estructuras, es potencialmente valioso pues podría permitir extrapolarlo a otro tipo de materiales y aplicaciones.Aparte de las bellas figuras que nos ofrece, la estructura del hielo es responsable de la menor densidad del hielo (0,917 g/mL) respecto al agua líquida (1,000 g/mL). El hielo cristalino contiene una gran cantidad de espacios vacíos en los centros de los anillos hexagonales, lo que resulta en moléculas de H2O más separadas en el hielo que en el agua líquida cerca del punto de fusión, y en consecuencia en una menor densidad. Esta diferencia de densidades tiene consecuencias significativas en la naturaleza, puesto que al flotar el hielo sobre el agua, impide que en climas gélidos los fondos marinos se congelen y que la vida subacuática desaparezca en esas zonas. La menor densidad del hielo implica también un aumento de volumen al congelarse el agua, algo que más de uno habrá notado al intentar enfriar envases de refresco, cerveza o vino en el congelador.
Referencias
- Kotz, J. C.; Joesten, M. D.; Wood, J. L.; Moore, J. W. (1994) The Chemical World: Concepts and Applications, Saunders College Publishing
- Cotton, F. A.; Wilkinson, G. (1988) Advanced Organic Chemistry, John Wiley & Sons.
- SnowCrystals.com, http://www.its.caltech.edu/~atomic/snowcrystals/, y referencias allí citadas.
- The Crystal Chemistry of Snowflakes, ChemLin-Virtual Chemistry Library, http://www.chemlin.net/news/2006/dec2006/crystal-chemistry.htm
Fotografía
"La fuerte ola de frío se lleva a una anciana en Alemania", Agencia EFE (7/1/2009), publicada en Diario de Avisos, Tenerife.



No hay comentarios:
Publicar un comentario