
jueves, 23 de diciembre de 2010
Felices Fiestas

viernes, 26 de noviembre de 2010
Réaumur
 "... en el cráter los vapores de azufre hirviendo agujereaban nuestra ropa y las manos se agarrotaban a dos grados Réaumur (2,5 grados centígrados). ¡Dios! qué sensación a esa altura (1.500 pies, 3.505,2 m) ..."
"... en el cráter los vapores de azufre hirviendo agujereaban nuestra ropa y las manos se agarrotaban a dos grados Réaumur (2,5 grados centígrados). ¡Dios! qué sensación a esa altura (1.500 pies, 3.505,2 m) ..."Aunque casi desconocida en la actualidad, la escala Réaumur gozó de gran aceptación en Francia y en la mayor parte de Europa continental durante el s. XVIII. El estudioso y aristócrata francés René Antoine Ferchault de Réaumur (1683-1757) la propuso en 1730, y estuvo vigente hasta comienzos del s. XIX, cuando la escala Celsius fue adoptada oficialmente por Francia como parte del sistema decimal de medidas (1794). Por otro lado, el termómetro y la escala Fahrenheit, ampliamente utilizados en Gran Bretaña y los Países Bajos, fueron ignorados en el resto de países europeos con mayor influencia de la cultura francesa.
Descubramos el por qué del auge y el ocaso de la escala Réaumur a través del siguiente test realizado con el programa EdiLIM,
Referencias
- Jaster, A.; Hernández, U. G. "El Comienzo de un largo viaje. Humboldt en Tenerife" Ediciones Baile del Sol, 2010.
- Gaussen, M. "Dissertation sur le thermomètre de Réaumur" Académies Roiales ou Sociétés des Sciences de Montpellier, Toulouse, Bordeaux, Stockholm, Upfal & Lausanne, 1789.
- Bolton, H. C. "Evolution of the thermometer" The Chemical Publishing Co., 1900, Easton, PA
Imágenes
miércoles, 13 de octubre de 2010
Rankine
William John Macquorn Rankine (Edimburgo 1820, Glasgow 1872), ingeniero y físico, trabajó desde joven en toda clase de proyectos de ingeniería civil. En 1855 fue elegido jefe del Departamento de Ingeniería Civil en la Universidad de Glasgow. Allí colaboró con William Thomson, a quien le unía la fascinación por la naturaleza y las propiedades del calor. Fue uno de los primeros en relacionar calor y trabajo en términos de energía, e introducir las nociones de energía cinética (actual/sensible energy), energía potencial (potential/latent energy) y entropía, conceptos que paralelamente estaban siendo estudiados también por Thomson y el físico alemán Rudolf Clausius. Hoy, 160 años más tarde, todos reconocemos que la temperatura de un cuerpo es producto de la energía cinética de sus constituyentes, como lo dice la pequeña de un post anterior; pero en 1850, éste era un concepto audaz que aparecía tímidamente en boca de los físicos teóricos. Su definición en términos energéticos vendría mucho después, luego que el principio de la conservación de la energía fuera totalmente desarrollado.
Hijo de un teniente de la armada británica y él mismo oficial voluntario durante unos años, Rankine tenía un fuerte sentimiento patriótico que reflejó en numerosas piezas humorísticas que él mismo componía e interpretaba tocando el piano en sus horas de ocio. En una de ellas, The Three Foot Rule, defíende la supervivencia del tradicional sistema de medidas británico que en ese entonces ya se veía amenazado por el sistema centesimal, y quién sabe, tal vez sea por esa defensa a ultranza lo que ayudó a que se le diera un justo homenaje dándole su nombre a esta escala de temperatura absoluta. Aquí una traducción libre de un extracto de "The Three Foot Rule":
Cuando era un joven aprendiz, y me esforzaba por usar mis manos,
la gente no hablaba de medidas que venían de países lejanos.
Ahora soy un trabajador británico ya mayor, y al colegio no volveré,
así que ya sea el cincel o la lima lo que sostenga, a mi regla de tres pies me ceñiré.
Algunos hablan de milímetros, y algunos de kilogramos,
y algunos de decilitros, para medir cerveza y tramos;
pero soy un trabajador británico ya mayor, y al colegio no volveré,
así que por libras comeré, y por cuartos beberé, y por mi regla de tres pies trabajando seguiré.

Referencias
- Raman, V. V. "William John Macquorn Rankine (1820-1872)", J. Chem. Ed. 1973, 50, 274.
- Rankine, J. W. M. "Miscellaneous Scientific Papers", Charles Griffin and Company, London, 1881, http://www.archive.org/details/miscellaneoussci00rank
- Rankine, J. W. M. "Songs and Fables", James Maclehose, Glasgow, 1874, http://archive.org/stream/songsandfablesil00rankuoft
Imagen
Generada haciendo uso de Textorizer a partir de una fotografía de W. Rankine y el texto de este post.
lunes, 15 de febrero de 2010
Kelvin
 En 1848 William Thomson, un joven profesor de ciencias de la Universidad de Glasgow, se encontraba enfrascado en estudios teóricos sobre las máquinas de calor, desarrollados pocos años antes por el físico francés Sadi Carnot. Según la teoría de Carnot, el rendimiento de una máquina reversible, que transforme calor en trabajo mecánico, está en función únicamente de las dos temperaturas en las que trabaja la máquina. Sin embargo, los cálculos de Thomson tropezaban con las escalas de temperatura conocidas en ese entonces, que requerían el uso de valores negativos para bajas temperaturas y sobretodo porque el punto cero de las escalas estaba definido de forma arbitraria. Thomson resolvió el problema al proponer la primera escala termodinámica de la temperatura en la que tenía en cuenta "el cero absoluto". Estableció su nueva escala partiendo de la premisa que los valores de temperatura son proporcionales a los calores absorbidos y cedidos por una máquina de Carnot. Haciendo uso de la ecuación que define el rendimiento o eficiencia de una máquina de calor, determinó el cero absoluto en su escala.
En 1848 William Thomson, un joven profesor de ciencias de la Universidad de Glasgow, se encontraba enfrascado en estudios teóricos sobre las máquinas de calor, desarrollados pocos años antes por el físico francés Sadi Carnot. Según la teoría de Carnot, el rendimiento de una máquina reversible, que transforme calor en trabajo mecánico, está en función únicamente de las dos temperaturas en las que trabaja la máquina. Sin embargo, los cálculos de Thomson tropezaban con las escalas de temperatura conocidas en ese entonces, que requerían el uso de valores negativos para bajas temperaturas y sobretodo porque el punto cero de las escalas estaba definido de forma arbitraria. Thomson resolvió el problema al proponer la primera escala termodinámica de la temperatura en la que tenía en cuenta "el cero absoluto". Estableció su nueva escala partiendo de la premisa que los valores de temperatura son proporcionales a los calores absorbidos y cedidos por una máquina de Carnot. Haciendo uso de la ecuación que define el rendimiento o eficiencia de una máquina de calor, determinó el cero absoluto en su escala. La máquina de calor alcanza la máxima eficiencia (100%, e = 1), cuando la temperatura es cero, el menor valor posible en esta escala.
La máquina de calor alcanza la máxima eficiencia (100%, e = 1), cuando la temperatura es cero, el menor valor posible en esta escala.Thomson dio a conocer su nueva escala en el artículo "On an Absolute Thermometric Scale": usa la graduación de la escala Celsius, pero estableciendo el "frío infinito" (cero absoluto) como el punto cero de su escala. Como Gay-Lussac en sus estudio de dilatación de los gases, Thomson calculó que el cero absoluto se hallaba a -273 °C.
William Thomson (Belfast, 1824-1907) quedó huérfano de madre a los 6 años y nunca asistió a la escuela, pero desde muy pequeño descubrió las matemáticas de manos de su padre, quien se encargó de su educación. Cuando William contaba con 8 años, su familia se mudó a Glasgow, donde su padre se hizo cargo del Departamento de Matemáticas de la Universidad. Siendo aún muy joven ingresó a la Universidad de Glasgow y luego a la de Harvard, donde estudió matemáticas y ciencia. Posteriormente fue a París para realizar estudios de física, y a los 22 años se convirtió en profesor de ciencias de la Universidad de Glasgow. Thomson desarrolló teorías en termodinámica, magnetismo y electricidad. Llevó a la práctica muchos de sus estudios al diseñar diversos instrumentos, uno de los más famosos es el que permitió instalar el telégrafo transatlántico entre Irlanda y la actual Terranova, Canadá. Su prolífica carrera lo llevó a que lo nombraran Sir a los 34 años y Barón, o Lord como se les llama habitualmente a los Barones, a los 68 años. Fue él mismo quien propuso que su título fuera el de Baron Kelvin of Largs, en recuerdo del río Kelvin que pasa cerca de la Universidad de Glasgow, mientras que Largs hace referencia al lugar donde tenía su casa de campo, cerca del pueblo de Largs, y donde finalmente murió a los 83 años. El nombre Kelvin se emplea hoy en día no sólo para identificar a William Thomson sino también para denominar la unidad de la escala absoluta de temperaturas.
 Referencias
Referencias- The Straight Dope, Why do we have so many temperature scales?, December 28, 2004, http://www.straightdope.com/columns/read/2191/why-do-we-have-so-many-temperature-scales
- Escalas de Temperatura, La Enciclopedia-El País, pp. 14792-4, Ed. Salvat, 2003
- General Chemistry Online!, Why is the difference between Celsius and Kelvin temperatures 273 units?, http://antoine.frostburg.edu/chem/senese/101/measurement/faq/why-273.15-kelvin.shtml
- Silvanus P. Thomson, Lord Kelvin biography, IEC, http://www.iec.ch/about/history/articles/lkbio-e.htm
- In Depth Info, Lord Kelvin and His Scale, http://www.indepthinfo.com/temperature/kelvin.htm
- La Temperatura y su Medida, La Enciclopedia del Estudiante-El País, tomo 12: Física y Química, pp. 28-9Ed. Santillana, 2005.
Imagen
- William Thomson, 1st Baron Kelvin
- Firma de Kelvin
- Wordle creado usando el texto de este post.
domingo, 24 de enero de 2010
Bonne année! Bonne santé!
 Este es el primer saludo que se dan los franceses al verse por primera vez en el nuevo año, y me pareció muy apropiado usarlo para mi primer post del 2010: Feliz año y que la salud les acompañe.
Este es el primer saludo que se dan los franceses al verse por primera vez en el nuevo año, y me pareció muy apropiado usarlo para mi primer post del 2010: Feliz año y que la salud les acompañe.- Conservar la salud
- No perder el optimismo
- Luchar contra la desinformación
¡Qué disfruten de un feliz año!
Imagen realizada utilizando wordle
miércoles, 16 de septiembre de 2009
Química y humor gráfico

Existen herramientas que permiten personalizar personajes pre-diseñados por el programa, como Bitstrips. Aunque no es precisamente un cómic, con La temperatura a escala atómica pretendía enunciar un concepto de manera distendida, aunque debo trabajar más en mi personaje.
lunes, 14 de septiembre de 2009
lunes, 17 de agosto de 2009
Coincidencias termométricas
 ¿Qué tienen en común los velocistas Usain Bolt y Tyson Gay? Además de ser los hombres más rápidos del planeta al día de hoy, provienen de los dos únicos países en los que la escala Fahrenheit es utilizada de forma habitual por sus ciudadanos: Jamaica y Estados Unidos. El récord impuesto por el jamaicano Bolt (¡9,58 segundos!) es de infarto.
¿Qué tienen en común los velocistas Usain Bolt y Tyson Gay? Además de ser los hombres más rápidos del planeta al día de hoy, provienen de los dos únicos países en los que la escala Fahrenheit es utilizada de forma habitual por sus ciudadanos: Jamaica y Estados Unidos. El récord impuesto por el jamaicano Bolt (¡9,58 segundos!) es de infarto. Fotografía
Récord del mundo de Bolt - Foto finish, Foto AFP, http://www.marca.com/albumes/2009/08/16/bolt/index_4.html
Celsius
 Como ya vimos con Fahrenheit, la evolución del termómetro y las escalas de temperatura fueron fruto de la habilidad, el ingenio, y en última instancia del sentido práctico de sus descubridores. La escala Celsius es buen ejemplo de ello.
Como ya vimos con Fahrenheit, la evolución del termómetro y las escalas de temperatura fueron fruto de la habilidad, el ingenio, y en última instancia del sentido práctico de sus descubridores. La escala Celsius es buen ejemplo de ello.- InDepthInfo, "Anders Celsius and His Scale", http://www.indepthinfo.com/temperature/celsius.htm
- Linné on line, Uppsala University, "Linnaeus' thermometer", http://www.linnaeus.uu.se/online/life/6_32.html
Fahrenheit

- InDepthInfo, "Fahrenheit: The Man and His Scale", http://www.indepthinfo.com/temperature/fahrenheit.htm
- Chemistry Enciclopedia, "Fahrenheit, Daniel Gabriel", http://www.chemistryexplained.com/Di-Fa/Fahrenheit-Daniel-Gabriel.html
- Sizes, "Fahrenheit temperature scale", http://www.sizes.com/units/temperature_Fahrenheit.htm
- Cecil Adams"On the Fahrenheit scale, do 0 and 100 have any special significance?", http://www.straightdope.com/columns/read/1266/on-the-fahrenheit-scale-do-0-and-100-have-any-special-significance
- Chemistry Daily, "Fahrenheit", http://www.chemistrydaily.com/chemistry/Fahrenheit
- Cecil Adams, "Why do we have so many temperature scales?", http://www.straightdope.com/columns/read/2191/why-do-we-have-so-many-temperature-scales
lunes, 9 de marzo de 2009
Marie Curie
 "Dejamos de temer aquello que se ha aprendido a entender"
"Dejamos de temer aquello que se ha aprendido a entender"En homenaje al Día de la Mujer Trabajadora, aquí va un crucigrama sobre la vida y obra de Marie Curie, creado con el programa HotPotatoes.
Referencias
- Curie, M. "Radium and Radioactivity", http://www.physics.ucla.edu/~cwp/articles/curie.htm
- Fröman, N. "Marie and Pierre Curie and the Discovery of Polonium and Radium" NobelPrize.org, http://nobelprize.org/nobel_prizes/physics/articles/curie/
- Strathern, P. (1999) "Curie y la radiactividad" Siglo XXI de España Editores.
Fotografía
Chemists Pierre Curie and wife Marie Curie in their laboratory, Life, http://images.google.com/hosted/life/l?q=chemist+source:life&prev=/images%3Fq%3Dchemist%2Bsource:life%26ndsp%3D20%26hl%3Des%26sa%3DN%26start%3D20&imgurl=1341b0be4f66d704
viernes, 6 de marzo de 2009
Compuestos quitanieves
 Recuerdo una noche preciosa en el campus de NC State después de una nevada, con los árboles coronados por nieve y estalactitas de hielo colgando de sus ramas. Todo alrededor parecía brillar. Como si la escena hubiera sido sacada de una película de cine. Mientras me preguntaba por qué no había gente en las calles disfrutando del espectáculo, casi tuve un resbalón, el primero de muchos que sufrí hasta llegar a casa. Y aunque es indudable la belleza que ofrecen el hielo y la nieve, no es posible olvidar sus peligros para el tránsito por calles y carreteras.
Recuerdo una noche preciosa en el campus de NC State después de una nevada, con los árboles coronados por nieve y estalactitas de hielo colgando de sus ramas. Todo alrededor parecía brillar. Como si la escena hubiera sido sacada de una película de cine. Mientras me preguntaba por qué no había gente en las calles disfrutando del espectáculo, casi tuve un resbalón, el primero de muchos que sufrí hasta llegar a casa. Y aunque es indudable la belleza que ofrecen el hielo y la nieve, no es posible olvidar sus peligros para el tránsito por calles y carreteras.Para mantener a raya los resbalones, patinazos, choques y accidentes a causa del hielo y la nieve, se esparcen millones de toneladas de sustancias químicas para retirar el hielo del pavimento. En una típica operación quitanieves, se retira primero la mayor cantidad de nieve de las carreteras con palas o maquinaria adecuada, y luego una mezcla de sal, arena y/o líquido descongelante se esparce sobre la nieve o el hielo que queda en la superficie. Después de transcurrido el tiempo suficiente para que la nieve o el hielo se suavice, se retira el material resultante (una especie de salmuera).
En contacto con el hielo, los compuestos quitanieves se disuelven lentamente, formando una solución cuyas propiedades difieren de manera importante de los del agua pura. Mientras que el agua se congela a O°C, las soluciones acuosas se congelan a menores temperaturas. Una aplicación práctica del descenso del p.f. son los compuestos quitanieves.
Probemos nuestros conocimientos sobre los compuestos quitanieves, contestando el siguiente test creado con HotPotatoes.
El uso a gran escala de las sales (NaCl, MgCl2 y CaCl2) desde los años 60 para el mantenimiento de carreteras ha generado graves efectos secundarios en su entorno:
- Acción corrosiva. Mientras que la oxidación del hierro ocurre espontáneamente en ambientes donde tanto el O2 como el H2O se encuentran presentes, la presencia de sales intensifica la reacción de oxidación. Los iones de las sales actúan como electrolitos, asegurando el flujo de electrones como un puente salino en una celda voltaica. La aplicación de sales en las carreteras puede corroer en pocos años vehículos, puentes y guardaraíles. Es por esta razón que el uso de las sales se encuentra prohibido en los aviones y aeropuertos, donde las condiciones de seguridad son mayores.
- Daños medioambientales. Una vez derretido el hielo y la nieve de las carreteras, las sustancias quitanieves se depositan en la vegetación y el suelo adyacente para depositarse eventualmente en los ríos y acuíferos locales. Los altos niveles de sal en el suelo inhiben la habilidad de la vegetación para absorber agua y nutrientes, disminuyendo su crecimiento y afectando el habitat de los animales de la zona. Por otro lado, el agua salina que entra a los lagos y acuíferos tiende a acumularse en los fondos al ser mayor su densidad, dificultando la circulación del agua. Para mantener un sistema ecológico saludable es esencial la mezcla de las capas de agua para distribuir el oxígeno y los nutrientes dentro de los lagos.
En los años 90 se introdujeron sales orgánicas como alternativa a las sales tradicionales. La más usada es el acetato de calcio y magnesio, menos corrosivo y con un menor impacto medioambiental. Sin embargo, tiene también sus desventajas. Aunque el acetato es biodegradable, su descomposición en CO2 y H2O causa una merma del O2 disuelto en el agua, mientras que en el suelo puede producir la precipitación de carbonatos metálicos e incrementar el pH. Además, funde el hielo a menor velocidad que las sales inorgánicas y es más caro.
En el caso de los aviones, se usan compuestos quitanieves líquidos, que actúan con mayor rapidez sobre el hielo y trabajan a menores temperaturas que las sales sólidas. Son por lo general mezclas de etilénglicol y propilénglicol, a los que se les añade un 10-20% de aditivos: inhibidores de corrosión, agentes espesantes, surfactantes, entre otros. La mezcla resultante exhibe una mayor toxicidad que los glicoles en estado puro, y como los compuestos quitanieves orgánicos antes vistos, también tienen efectos adversos en el medio ambiente: contaminan el agua reduciendo el oxígeno disuelto en las corrientes o lagos al degradarse.
Para retirar el hielo de las pistas de aterrizaje en aeropuertos de E.E.U.U. y Canadá, se emplea acetato de potasio, y en menor escala acetato de sodio, formiato de potasio y formiato de sodio. Su elección se basa en que las sales de acetato tienen un menor efecto medioambiental, y son mucho menos tóxicos que los reactivos basados en urea y glicoles. Pero hay que añadir una desventaja más al uso de estos compuestos: deterioran el asfalto.
Todos coincidiremos en que mantener las carreteras libres de hielo y nieve es esencial para nuestra seguridad en inviernos tan fríos como el que nos ha tocado este año. Pero no por eso podemos cerrar los ojos a los daños que causamos a nuestro entorno usando compuestos quitanieves. Es necesario llevar a cabo una mayor investigación para desarrollar compuestos químicos alternativos a los quitanieves hoy conocidos, pero en el corto plazo es posible reducir el daño medioambiental si empleamos la cantidad adecuada y no un exceso de estos compuestos e instalamos sistemas de recuperación para su reciclado y para capturar los aditivos que se añaden a estas sustancias.
Referencias
- Castro, C. "Varios países cuestionan la sal 'quitanieves' por su daño ambiental", Sociedad, El País, 16 Ene 2009.
- Viadero, R.C. "Roadway Deicing and the Environment", Government Engineering, Jan-Feb 2005, 32-33, http://www.govengr.com/environment/env_0105.pdf
- Kotz, J. C.; Joesten, M. D.; Wood, J. L.; Moore, J. W. The Chemical World: Concepts and Applications, Saunders College Publishing, 1994.
- Schueler, T. "Snow, Road Salt, and the Chesapeake Bay", Center for Watershed Protection, http://www.cwp.org/Resource_Library/Special_Resource_Management/ColdClimate/snow_roadsalt_chesbay.pdf
- Brown, T. L.; LeMay, H. E.; Bursten, B. E.; Burdge, J. R. en Chemistry-The Central Science, Pearson Education, Inc., N.J., 2003.
- Senese, F. "Why does salt melt ice?", General Chemistry Online!, http://antoine.frostburg.edu/chem/senese/101/solutions/faq/why-salt-melts-ice.shtml
- Helmenstine, A.M. "Melting Snow & Ice with Salt", About.com: Chemistry, http://chemistry.about.com/cs/howthingswork/a/aa120703a.htm
- Ramakrishna, D. M.; Viraraghavan, T. "Environmental Impact of Chemical Deicers-A Review", Water, Air, and Soil Pollution 2005, 166, 49-63, http://www.springerlink.com/content/q67285l92u757226/?p=604d72fca59f469eb95d913584c05515&pi=4
- Ritter, S. "Aircraft Deicers" C&EN 2001, 79, 30, http://pubs.acs.org/cen/whatstuff/stuff/7901scit5.html
- Advanced Asphalt Technologies "AATP Project 05-03: Effect of Deicing Chemicals on HMA Airfield Pavements" 2007, http://www.aaptp.us/Report.Interim.05-03.pdf
- Posegate, A. "Deicer Dilemma: How to Choose and How to Use" Metro, Washington Post, Jan. 29, 2009, http://voices.washingtonpost.com/capitalweathergang/2009/01/deicer_dilemma.html
- Luis Sevillano "Operarios de limpieza echan sal contra las heladas" Sociedad, El País, 16 Ene 2009, http://www.elpais.com/articulo/sociedad/Varios/paises/cuestionan/sal/quitanieves/dano/ambiental/elpepusoc/20090116elpepisoc_5/Tes
- Salinas del Janubio, Lanzarote, http://www.visitacanarias.com/ISLAS/LANZAROTE/SECCIONES/SABOR_MAR/sabor_mar01.html
miércoles, 11 de febrero de 2009
Hielo
 Muchos recordaremos este invierno como uno de los más fríos de los últimos años. Fuertes vientos, lluvias constantes, mucha nieve, .... Y aunque en Canarias no es frecuente ver estampas nevadas como las que se ven en los bosques de Alemania, finalmente ha sido el último temporal el que nos ha dejado nieve en las cumbres.
Muchos recordaremos este invierno como uno de los más fríos de los últimos años. Fuertes vientos, lluvias constantes, mucha nieve, .... Y aunque en Canarias no es frecuente ver estampas nevadas como las que se ven en los bosques de Alemania, finalmente ha sido el último temporal el que nos ha dejado nieve en las cumbres.Pero si a gran escala la nieve nos proporciona paisajes de gran belleza, a nivel microscópico los cristales de hielo son una obra de arte.
 Sorprende saber que los copos de nieve se forman en las nubes sobre partículas de polvo, cuya superficie ayuda a que el vapor de agua se condense para convertirse luego en cristales de hielo. ¿Pero cómo adquieren esas formas simétricas tan espectaculares?
Sorprende saber que los copos de nieve se forman en las nubes sobre partículas de polvo, cuya superficie ayuda a que el vapor de agua se condense para convertirse luego en cristales de hielo. ¿Pero cómo adquieren esas formas simétricas tan espectaculares?
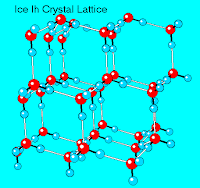 A tamaños muy pequeños, los cristales de nieve toman la forma de prismas hexagonales, pero a medida que el cristal crece surgen pequeñas ramificaciones desde cada esquina del hexágono, ramificaciones que van creciendo en tamaño al continuar el proceso de cristalización y de las que a su vez brotan nuevas ramificaciones, obteniéndose formas más elaboradas además de únicas. El proceso por el que aparecen estas ramificaciones, así como la complejidad de las mismas, es tema de estudio en el área de física. La forma cómo crecen los cristales de nieve está sujeto a un delicado equilibrio entre hielo y vapor de agua, equilibrio que depende de la temperatura y la humedad del medio. Estos estudios son un buen ejemplo de lo que comúnmente se denomina ciencia básica. El conocimiento de cómo, cuándo y por qué se auto-ensamblan las moléculas de agua en determinadas estructuras, es potencialmente valioso pues podría permitir extrapolarlo a otro tipo de materiales y aplicaciones.
A tamaños muy pequeños, los cristales de nieve toman la forma de prismas hexagonales, pero a medida que el cristal crece surgen pequeñas ramificaciones desde cada esquina del hexágono, ramificaciones que van creciendo en tamaño al continuar el proceso de cristalización y de las que a su vez brotan nuevas ramificaciones, obteniéndose formas más elaboradas además de únicas. El proceso por el que aparecen estas ramificaciones, así como la complejidad de las mismas, es tema de estudio en el área de física. La forma cómo crecen los cristales de nieve está sujeto a un delicado equilibrio entre hielo y vapor de agua, equilibrio que depende de la temperatura y la humedad del medio. Estos estudios son un buen ejemplo de lo que comúnmente se denomina ciencia básica. El conocimiento de cómo, cuándo y por qué se auto-ensamblan las moléculas de agua en determinadas estructuras, es potencialmente valioso pues podría permitir extrapolarlo a otro tipo de materiales y aplicaciones.- Kotz, J. C.; Joesten, M. D.; Wood, J. L.; Moore, J. W. (1994) The Chemical World: Concepts and Applications, Saunders College Publishing
- Cotton, F. A.; Wilkinson, G. (1988) Advanced Organic Chemistry, John Wiley & Sons.
- SnowCrystals.com, http://www.its.caltech.edu/~atomic/snowcrystals/, y referencias allí citadas.
- The Crystal Chemistry of Snowflakes, ChemLin-Virtual Chemistry Library, http://www.chemlin.net/news/2006/dec2006/crystal-chemistry.htm
Fotografía
"La fuerte ola de frío se lleva a una anciana en Alemania", Agencia EFE (7/1/2009), publicada en Diario de Avisos, Tenerife.
sábado, 27 de diciembre de 2008
Recursos virtuales para el profesor de química
 Basado en uno de mis trabajos del curso e-Learning 2.0.
Basado en uno de mis trabajos del curso e-Learning 2.0.La introducción de las TIC en la enseñanza de la química busca promover un aprendizaje más inquisitivo, descentralizado y participativo. Para ello es fundamental que el profesorado esté capacitado para aprovechar las posibilidades de las nuevas tecnologías, como es el uso interactivo con el material educativo, el desarrollo de proyectos colaborativos, la utilización de materiales multimedia de apoyo, y el uso de nuevos sistemas de autoaprendizaje. En internet se puede encontrar una serie de recursos para la autoformación de los profesores de química, entre ellos:
- Tutoriales o cursos virtuales
- Herramientas de autor
- Portales educativos
- Edublogs de química
1. Tutoriales
a) Herramientas web 2.0 para el aula. Muchos de los cursos han sido elaborados por profesores de manera altruista.
- Cursos de herramientas web en el aula
- Anigara 2.0
- Curso sobre wikis
- Creación y uso educativo de blogs
- WebTools 4u2use
- Aula 21. Para programas como WebQuestions 2.0 y HotPotatoes. Consejos para diseñar WebQuest y Cazas de Tesoros.
- Bitácora de Aníbal de la Torre. Cursos sobre Moodle, PowerPoint, etc.
No existen demasiadas aplicaciones buenas y de fácil uso para crear actividades interactivas; entre ellas destacan las siguientes:
- Crocodile Chemistry. Software propietario (de pago). Simula un laboratorio de química donde es posible diseñar experimentos y reacciones químicas.
- Course Genie. Software propietario. Permite que los materiales desarrollados en Word sean convertidos fácilmente en cursos interactivos basados en páginas web.
- eXe. Software de código abierto y gratuito. Permite crear módulos educativos, conteniendo p. ej. objetivos, estudios de caso, actividades de lectura, cuestionarios, etc., y exportarlos de maneras diferentes.
- LIM. Software de uso libre. Permite crear actividades de tipo Flash.
- HotPotatoes. Software gratuito para educación. Hace posible elaborar cuestionarios y actividades interactivas basadas en páginas web. Permite integrar animaciones Flash.
- Reseña de Recursos para Química
Ofrecen todo tipo de recursos virtuales para el aula. Ejemplos de portales para la enseñanza de química son:
4. Edublogs de química
Redes o comunidades de profesores de química que colaboran en el desarrollo de actividades educativas virtuales. Algunos ejemplos son:
- Recursos de Física y Química y algo más
- Aula de Física y Química
- FisQuiWeb
- Química Blog
- Bitácora de Aníbal de la Torre
- Internet en el Aula






